martes, 2 de junio de 2015
miércoles, 27 de mayo de 2015
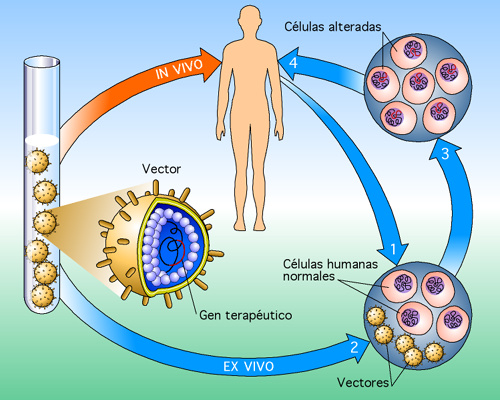
5. Terapia Génica
La TERAPIA GÉNICA es un tratamiento médico que consiste en manipular la información genética de células enfermas para corregir un defecto genético o para dotar a las células de una nueva función que les permita superar una alteración.
En principio existen tres formas de tratar enfermedades con estas
terapias:
· Sustituir genes alterados.
Se pueden
corregir mutaciones mediante cirugía génica, sustituyendo el gen defectuoso o
reparando la secuencia mutada.
Inhibir o contrarrestar efectos dañinos.
Se lleva
a cabo mediante la inhibición dirigida de la expresión génica. Este proceso se
desarrolla bloqueando promotores, interfiriendo con los mecanismos de expresión
génica mediante RNAs anti-sentido que son complementarios de RNA-m y se unen a
ellos bloqueándolos, o, más recientemente, mediante siRNA, "RNAs pequeños
interferentes", que bloquean secuencias específicas de RNA, por lo que
pueden inhibir cualquier gen bloqueando sus RNA-m.
· Insertar genes nuevos.
Se
realiza por supresión dirigida de células específicas. Se insertan genes
suicidas que destruyen a la propia célula que los aloja o genes estimuladores
de la respuesta inmune. También se puede introducir una copia de un gen normal
para sustituir la función de un gen mutante que no fabrica una proteína
correcta.
Estos son
los vectores utilizados en la terapia génica:
características para un vector:
- Que sea reproducible.
- Que sea estable.
- Que permita la inserción de material genético sin límite de tamaño.
- Que permita la transducción tanto en células en división como en aquellas que no están proliferando.
- Que posibilite la integración del gen terapéutico en un sitio específico del genoma.
- Que se integre una vez por célula, para poder controlar la dosis.
- Que reconozca y actúe sobre células específicas.
- Que la expresión del gen terapéutico pueda ser regulada.
- Que carezca de elementos que induzcan una respuesta inmune.
- Que pueda ser caracterizado completamente.
- Que sea inocuo o que sus posibles efectos secundarios sean mínimos.
- Que sea fácil de producir y almacenar.
- >Que todo el proceso de su desarrollo tenga un coste razonable.
VECTORES:
Virus
Todos los virus son capaces de introducir su material genético en la célula huésped como parte de
su ciclo de . Gracias a
ello, pueden producir más copias de sí mismos, e infectar a otras células.
Algunos tipos de virus insertan sus genes físicamente
en el del huésped, otros pasan por varios
orgánulos celulares en su ciclo de infección y otros se replican directamente
en el citoplasma, por lo que en función de la terapia a realizar nos puede
interesar uno u otro.
Retrovirus
El genoma de los retrovirus está constituido por ARN de cadena
sencilla, en el cual se distinguen tres zonas claramente definidas: una
intermedia con genes estructurales, y dos flanqueantes con genes y estructuras
reguladoras. Cuando un retrovirus infecta a una célula huésped, introduce su ARN junto con algunas enzimas;que se encuentran en la matriz, concretamente una <, una transcriptasa
inversa y una integrasa.
La acción de la retrotranscriptasa
permite la síntesis del ADN genómico del virus a partir del ARN. A
continuación, la integrasa introduce este ADN en el genoma del huésped. A
partir de este punto, el virus puede permanecer latente o puede activar la
replicación masivamente.
Para usar los retrovirus como vectores
víricos para terapia génica inicialmente se eliminaron los genes responsables
de su replicación y se reemplazaron estas regiones por el gen a introducir
seguido de un gen marcador.
Adenovirus
adenovirus presentan un genoma de ADN bicatenario, y no integran
su genoma cuando infectan a la célula huésped, sino que la molécula de ADN
permanece libre en el núcleo;celular y se transcribe de forma
independiente. Esto supone que el efecto posicional o la mutagénesis por
inserción no se dan en estos vectores, lo cual no quiere decir que no tengan
otros inconvenientes. Además, debido al hecho de que en su ciclo natural se
introducen en el núcleo de la célula, pueden infectar tanto células en división
como células quiescentes.
A los vectores de primera generación se
les eliminó parte del gen E1, básica para la replicación, y a los de 2.ª, se
les eliminaron otros genes tempranos en el ciclo del virus. En ambos casos,
cuando se realiza una infección con una concentración elevada de virus, se
produce la expresión de otros genes que provocan una respuesta inmune
considerable.
Por ello, los últimos vectores basados
en adenovirus prácticamente han sido desprovistos de la mayor parte de sus
genes, con la excepción de las regiones repetidas de forma invertida, y la zona
necesaria para la encapsidación.
Virus Adenoasociados (AAV)
son virus pequeños con un genoma de
ADN monocatenario. Pueden integrarse específicamente en el cromosoma 19 con una alta probabilidad. Sin embargo, el VAArecombinante que se usa como vector y que no contiene ningún gen
viral, solo el gen terapéutico, no se integra en el genoma. En su lugar, el
genoma vírico recombinante fusiona sus extremos a través del ITR (repeticiones
terminales invertidas), apareciendo recombinación de la forma circular y episomal que se predice que pueden ser la causa de la expresión
génica a largo plazo.
Muchos ensayos con VAA están en curso o en
preparación, principalmente en el tratamiento de músculos y enfermedades
oculares, los dos tejidos donde el virus parece ser particularmente útil. Sin
embargo, se están comenzando a realizar pruebas clínicas, donde vectores
basados en el VAA son utilizados para introducir los genes en elcerebro. Esto es posible porque VAA pueden
infectar células que no están en estado de división, tales como las neuronas.
Herpes virus
Los herpesvirus son virus de ADN capaces de establecer latencia en sus
células huésped. Son complejos genéticamente hablando, pero para su uso como
vectores tienen la ventaja de poder incorporar fragmentos de DNA exógeno de
gran tamaño (hasta unas 30 kb). Además, aunque su ciclo lítico lo realizan en
el lugar de infección, establecen la latencia en neuronas, las cuales están
implicadas en numerosas enfermedades del sistema nervioso, y son por ello
dianas de gran interés.
Los vectores herpesvíricos puestos en marcha han usado
dos estrategias principales:
- La recombinación homóloga entre el genoma del virus
completo y el contenido en un plásmido que llevaba el transgén en la zona que
codifica para genes no esenciales en lo que se refiere a replicación e
infección.
- El uso de vectores con orígenes de replicación del
virus así como las correspondientes secuencias de empaquetamiento, y su
introducción en estirpes celulares bien coinfectadas con virus silvestres o
bien portadoras del resto de genes del mismo implicados en la encapsidación y
replicación, para permitir la formación de partículas virales recombinantes con
las que realizar el tratamiento.
No obstante, el uso de vectores basados en el HSV (virus del herpes
simple), sólo puede llevarse a cabo en pacientes que no hayan sido
infectados previamente por él, pues pueden presentar inmunidad.
miércoles, 13 de mayo de 2015
4. Ingenieria genética en animales
El enorme avance de la investigación biotecnológica en los últimos años ha favorecido el desarrollo de técnicas que permiten introducir, eliminar o modificar de forma específica un gen, o determinados tipos de genes, en el genoma de un organismo para producir seres vivos (animales, plantas y microorganismos) con nuevas y mejores características. Este tipo de técnicas, se encuadran dentro de lo que se denomina Ingeniería Genética y los seres vivos que así se obtienen son los llamados Organismos Modificados Genéticamente.
Existen dos estrategias básicas en la producción de animales trangénicos:
- Persiguen conseguir un animal que tenga una función diferente a la de sus antecesores: lo cual se consigue añadiendo un fragmento clonado de ADN al genoma de un animal.
- Producir animales que han perdido alguna funcion propia de los “wild type”: consiste en diseñar animales trangénicos a los que se les inducen perdidas de función, eliminando algun gen en concreto.
Ambas tienen objetivos similares:
1. La expresión de productos genéticos que anteriormente no existan
2. La sobre-expresión de genes que si que se encontraban previamente en el genoma
3. La síntesis de proteínas en células, tejidos u órganos diferentes a los habituales
4. La alteración de la regulación de sistemas enzimáticos o rutas metabólicas determinadas. Tanto en una estrategia como en la otra, es fundamental asegurar la habilidad para romper las cadenas e introducir, o extraer, los genes en lugares diana específicos ya que la eficacia del procedimiento depende de la posibilidad de reproducir las modificaciones que se persiguen y esto no se podrá conseguir si no somos capaces de garantizar la fiabilidad de la transferencia.
1. La expresión de productos genéticos que anteriormente no existan
2. La sobre-expresión de genes que si que se encontraban previamente en el genoma
3. La síntesis de proteínas en células, tejidos u órganos diferentes a los habituales
4. La alteración de la regulación de sistemas enzimáticos o rutas metabólicas determinadas. Tanto en una estrategia como en la otra, es fundamental asegurar la habilidad para romper las cadenas e introducir, o extraer, los genes en lugares diana específicos ya que la eficacia del procedimiento depende de la posibilidad de reproducir las modificaciones que se persiguen y esto no se podrá conseguir si no somos capaces de garantizar la fiabilidad de la transferencia.
Ventajas de manipulación genética en animales
De entre las aportaciones y aplicaciones de las técnicas de manipulación genética en animales, se destacan los siguientes:
- La clonación de ganado más productivo, por ejemplo, las vacas que producen más leche y de mejor calidad o las ovejas que producen más lana. Obtiene, si, por tanto, mayor crecimiento, con menor consumo de energía.
- Conservación de especies en peligro de extinción mediante el almacenamiento de semen congelado y embriones. Es importante destacar que este proceso es muy complicado y costoso y no garantiza el futuro de todas las especies que se pretendían salvar.
- Clonación de animales extintos, un tema controvertido y aún hoy discutido. Realización del trasplante de órganos animales para los seres humanos. En la actualidad se está probando el trasplante corazones de cerdos inmuno-compatibles con el ser humano para los monos. Se debe tener en cuenta la alta probabilidad de transmisión de patógenos humanos para los seres humanos.
- Producción de medicamentos (insulina, hormona del crecimiento y de factor de coagulación), que puede obtenerse a partir de leche de vacas, cabras y ovejas o transgénicos.
- Los aumentos en cantidad y variedad modificada por animales con características deseadas, haciendo posible obtener los mejores individuos para probar tratamientos sobre enfermedades humanas.
Ayuda en la comprensión de los mecanismos de proliferación y diferenciación celular. Producción de proteínas con interés terapéutico e industrial.
- Reducción del número de animales utilizados en experimentos de laboratorio. Posibilidad de utilizar los animales más pequeños genéticamente modificados para reemplazar las especies genéticamente más cercanos a los seres humanos.
- Riesgos de la manipulación genética en animales.
Desventajas de manipulación genética en animales
Según algunos científicos, la manipulación del genoma de los animales con el propósito de adquirir individuos con ciertas características presenta riesgos graves para la salud humana. Los riesgos más controvertidos son los siguientes:
- La falta de consecuencias a largo plazo de la introducción de OMG en entornos abiertos.
- Las reacciones alérgicas causadas por el consumo de carne, leche y huevos o cualquier otro alimento derivado de los organismos genéticamente modificados.
- Reducción de la biodiversidad a través de la aplicación de técnicas de mejora y selección de los animales. A menudo el hombre favorece a ciertas características que no son seleccionadas por la naturaleza (selección natural). Esto pone en debate la supervivencia de los seres vivos y las amenazas de las especies.
- Reducción de la biodiversidad a través de la aplicación de técnicas de mejora y selección de los animales. A menudo el hombre favorece a ciertas características que no son seleccionadas por la naturaleza (selección natural). Esto pone en debate la supervivencia de los seres vivos y las amenazas de las especies.
- Aspectos de consideración bioética sobre el sufrimiento animal.
miércoles, 6 de mayo de 2015
3. Ingeniería genética en vegetales. “Biotecnología”.
Como herramienta de
conocimiento, la ingeniería genética ha revolucionado el estudio de los
vegetales. “Sin ella no nos hubiéramos enterado de que una planta se da cuenta
cuando la tocamos”, ejemplifica el catedrático de la UPM. “Mediante su ayuda
hemos identificado nuevas hormonas vegetales y hemos dado grandes pasos en el
conocimiento del desarrollo de las plantas. Igualmente hemos aprendido acerca
de su inmunidad innata ante las enfermedades y de cómo ‘aprenden’ a adaptarse al
medio ambiente”.
Gracias a la biotecnología
es posible introducir en un cultivo un gen que le haga invulnerable a alguno de
sus agresores, se pueden diseñar vegetales a la carta, especialmente
adaptados a las condiciones climáticas y de suelo de cada región, y así
aumentar sus rendimientos. “Sin la ingeniería genética no habrá forma de
atender las crecientes necesidades de alimentos”, (García Olmedo).
Para transferir ADN a una planta se utilizan diversos vectores, que sirven de vehículo transmisor,
de alguna forma “engañan” a los mecanismos celulares que normalmente impedirían
la incorporación de una información genética extraña. Los vectores más utilizados son plásmidos
bacterianos, pequeñas moléculas circulares de ADN presentes en muchas
bacterias, que tienen gran facilidad para migrar y recombinarse. También se utilizan virus mutilados, en los que se ha eliminado la
información genética dañina, que tienen una gran capacidad invasora y pueden
incorporar su propia información genética al ADN de la planta. El gen extraño
que interesa transferir se inserta en el virus mutilado o en plásmidos (vectores),
generalmente de la bacteria Agrobacterium tumefaciens, que en la Naturaleza coloniza una
amplia gama de plantas y transfiere su propio ADN a las células vegetales
huésped, formando tumores que conocemos con el nombre de agallas. A
continuación se infecta un cultivo de células vegetales con
el virus recombinante o con cepas mutiladas de A. tumefaciens portadoras del plásmido con el
transgen. También se puede introducir el ADN extraño en las células mediante
microinyección, mediante electroporosis o mediante el bombardeo con
microproyectiles recubiertos de plásmidos (vectores) recombinantes. Las células transformadas se desarrollan en un cultivo in vitro para
regenerar plantas completas, que en teoría habrán incorporado el gen extraño y
lo llevarán en todas sus células.
miércoles, 29 de abril de 2015
2. Historia
Los criadores de ganado han aprovechado desde tiempos
remotos este fenómeno para mejorar la calidad de sus animales. Pero hasta fines
del siglo XIX, los métodos utilizados eran totalmente empíricos. Por ejemplo,
Robert Bakewell, famoso criador inglés del siglo XVIII, obtenía excelentes
resultados por el procedimiento de cruzar a sus animales con otros no
emparentados para conseguir los rasgos deseados y cruzar posteriormente entre
sí a los animales así obtenidos con el fin de estabilizar los caracteres conseguidos.
La
genética no surgió como ciencia hasta 1900, pero sus fundamentos habían sido
sólidamente establecidos 40 años antes por Gregor Mendel, monje moravo del
monasterio de Brno. Entre 1851 y 1853, su orden lo envió a Viena a estudiar
ciencias y, al regresar al monasterio, inició una serie de experimentos con la
planta del guisante (Pisum). Estudió siete características específicas
de esta planta, entre ellas, la forma de la semilla, el color de las flores y
la longitud del tallo.Llevando detallados registros sobre más de
20.000 ejemplares, descubrió que estas características eran hereditarias en un
coeficiente de 1:3. El cruzamiento de plantas de tallo largo con ejemplares de
tallo corto daba como resultado plantas de uno u otro tipo, nunca de altura
intermedia. Mendel supuso entonces que estas características eran transmitidas
por factores hereditarios específicos que estaban localizados en las células
germinales.
William James Beal
Oswald Avery
En
1944 Oswald Avery al aporta las primeras pruebas solidas de que en el ADN están
codificados los genes que determinan las cualidades de cada ser vivo. Este
descubrimiento planteó una posibilidad nueva de cultivo en la que, en lugar de
combinar a ciegas todos los genes de dos plantas hasta encontrar la combinación
que buscamos, los científicos pueden identificar los pocos genes implicados en
ese rasgo y transferir sólo esos genes a la planta, obteniendo una variedad de
la misma mejorada.
Con este avance nacería definitivamente lo que
hoy conocemos como ingeniería genética.
miércoles, 22 de abril de 2015
1. Introducción
Todo organismo, aún el más simple, contiene una enorme cantidad de información. Esta información se encuentra almacenada en una macromolécula que se
halla en todas las células: el ADN. Este ADN está dividido en gran cantidad de sub-unidades llamadas
genes. Cada gen contiene la información necesaria para que la célula sintetice una proteína. Así, el genoma, va a ser la responsable de las
características del individuo. Los genes controlan todos los aspectos de la vida de cada organismo.
¿Qué es la genética?
¿Qué es la ingeniería genética?
La
ingeniería genética se define como el estudio y manipulación de los genes de
organismos vivos para mejorar la vida del hombre. Posibilita
la corrección de los defectos genéticos y la creación de nuevos
microorganismos, además de conseguir
variedades de plantas y animales para una obtención más eficiente de sus
productos
Suscribirse a:
Comentarios (Atom)